Read this blog in:

Na tropie przywierania adenowirusów w Tybindze
Witam na naszym blogu! Nazywam się Aleksandra Stasiak i jestem doktorantką w grupie badawczej Profesora Thilo Stehle. Pracuję w Niemczech, na Uniwersytecie Eberharda Karola w Tybindze (Tübingen). Interesują mnie wirusy, a dokładniej, sposoby, w jakie wchodzą w interakcje z naszymi ciałami i jak temu zapobiegać. Mój projekt doktorancki dotyczy adenowirusa, a w tym wpisie chciałabym wytłumaczyć, po co i w jaki sposób go wykonuję.
Co i dlaczego?
Adenowirusy powodują różne choroby, takie jak zapalenie spojówek lub infekcje układu pokarmowego czy oddechowego. Mają jednak też i drugie oblicze jako potencjalne wektory dostarczające geny do komórek – mogłyby zostać wykorzystane w terapii genowej, leczeniu nowotworów czy tworzeniu nowych szczepionek. Mimo że badane były już w setkach testów klinicznych, możemy dalej pogłębiać naszą wiedzę o nich i je ulepszać do roli wektorów. By to osiągnąć, ważne jest zrozumieć, w jaki sposób adenowirusy wchodzą w interakcje z ludzkimi komórkami. Tę wiedzę moglibyśmy potem wykorzystać, by skierować je ku konkretnemu rodzajowi komórek, na przykład komórek rakowych w onkoterapii, albo komórek układu odpornościowego w szczepieniach.
Adenowirus rozpoczyna interakcje z komórką wiążąc się z białkami, które wystają z powierzchni komórki – nazywamy je receptorami wirusowymi. Sam wirus z kolei jest uporządkowaną paczką z białek, zwaną kapsydem. W jej środku znajduje się DNA i białka potrzebne przy infekcji, na zewnątrz zaś te, które rozpoczynają interakcję z komórką.
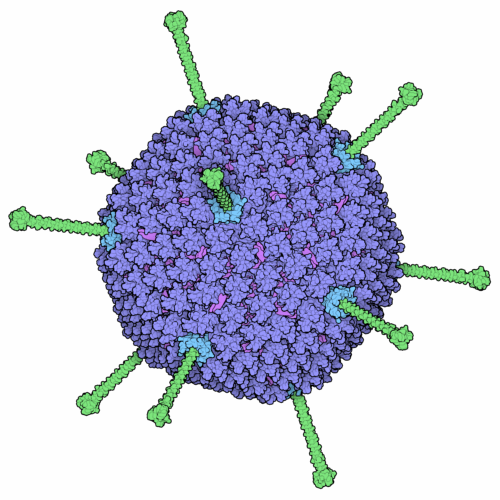
Kapsyd adenowirusa – heksony są pokolorowane na fioletowo, gałki włókniane na zielono, a baza pentonu na niebiesko. Rysunek autorstwa Davida Goodsella, opublikowany w Protein Data Bank (Baza Danych o białkach) w serii Molecule of the Month (cząsteczka miesiąca).
Kapsyd adenowirusa
Kapsydy wirusów składają się z tylko kilku rodzajów białek, powtarzających się wiele razy tworząc regularną konstrukcję. Kapsyd adenowirusa nie jest kulą, ale dwudziestościanem: ma 20 ścian i 12 wierzchołków (jak widać na rysunku). Najczęściej występującym w nim białkiem jest hekson, który powtarza się 720 razy. Na każdym wierzchołku kapsydu znajdują się białka, które wchodzą w interakcje z receptorami wirusowymi na powierzchni infekowanej komórki. Białka te to tzw. fibre knob (włókniana gałka), która wystaje z powierzchni kapsydu oraz penton, który znajduje się pod włóknem. Obydwa kompleksy białek wchodzą w interakcję z receptorami. Najpierw, gałka przywiera do jednego z kilku potencjalnych rodzajów receptorów przywierania, a następnie, penton przywiera do receptora wnikania – integryny – i wirus może wniknąć do komórki.
Interakcja między pentonem a integryną jest tematem mojego doktoratu i stanowi część sieci badań ViBrANT, której tematem przewodnim jest przywieranie patogenów. Integryny są znaczną rodzina białek znajdujących się na powierzchni komórki, odpowiedzialnych za przekazywanie wiadomości (sygnalizację) pomiędzy komórką i jej otoczeniem. Mają wpływ na wzrost, odporność i rozwój. W toku ewolucji, wirusy rozwinęły zdolność wykorzystywania wielu takich powszechnie wystepujących białek do infekowania komórek. W moim projekcie chcę zobaczyć, jak układają się w trzech wymiarach atomy pentonu i integriny i jakie tworzą wiązania. Pomoże nam to w projektowaniu wirusów zdolnych do selektywnego infekowania konkretnych typów komórek. Innym zastosowaniem może być projektowanie leków, które zapobiegają wiązaniu się i wnikaniu wirusa do ludzkich komórek.
Jak?
Żeby ustalić ułożenie atomów w białku albo kompleksie białkowym, używamy technik z biologii strukturalnej, o których wspominał już w swoim wpisie Andreas. Nasze laboratorium stosuje głównie krystalografię rentgenowską: białka w formie kryształów są bombardowane promieniami rentgenowskimi, a następnie, z zaobserwowanych obrazów dyfrakcyjnych, możemy ustalić jak ułożone są w nich atomy. Technika ta zasługuje zapewne na osobny wpis. Na teraz wystarczy powiedzieć, że samo zmuszenie białek do tworzenia kryształów jest już wyzwaniem i wymaga dużej ilości białka o wysokiej czystości.
Kto?
Urodziłam sie w Warszawie, gdzie uczęszczałam do gimnazjum i liceum. Po ukończeniu liceum studiowałam w Szkocji i Finlandii. W czerwcu 2018 uzyskałam tytuł magistra biochemii. Podczas nauki brałam udział w badaniach naukowych i postanowiłam, że chcę dalej próbować zrozumieć jak działają nasze ciała i jak wirusom udaje się nimi manipulować. Poza tym, uwielbiam poznawać nowe miejsca i bardzo się cieszę, że przeprowadziłam się do Niemiec, czwartego kraju w ciągu dwóch lat!



